Reglas de la UIQPA para escribir fórmulas y nombres de los compuestos químicos inorgánicos
A través de la historia, diversos personajes han contribuido a establecer el nombre de los elementos y compuestos químicos. Por ejemplo, en el periodo de la alquimia se utilizaban símbolos para reconocer elementos o compuestos que ya estaban descubiertos.
Posteriormente, el científico Dalton utilizó círculos con diversos símbolos, como se indica en la figura.

A medida que se fueron descubriendo más elementos, surgió la necesidad de idear un sistema de nomenclatura para facilitar su identificación sin importar el idioma que se tratara. Así, el sueco Berzelius, en 1814, propuso un sistema que constaba de símbolos y fórmulas. Por su parte, el francés Lavoisier comienza la clasificación de las sustancias químicas de acuerdo con sus propiedades y composición.

Actualmente el nombre que se le asigna a un elemento puede tener su origen en algún vocablo latino, griego, alemán, etc., o bien, en honor al lugar donde se descubrió a un científico notable. Por ejemplo:

Lo mismo pasó con los compuestos al principio se les asignaba nombre sin seguir reglas específicas, pues sólo se debía a las características o a alguna propiedad sobresaliente. A estos nombres se les considera aún como nombre común o trivial.
A continuación se presentan algunos ejemplos:

A consecuencia de esta nomenclatura y para evitar tener que memorizar cientos de nombres de compuestos, en 1921, se conformó la Unión Internacional de Química Pura y Aplicada (UIQPA) o IUPAC por sus siglas en inglés, que es la comisión encargada de revisar, modificar y establecer las reglas para dar el nombre sistemático a cada compuesto. En las reglas establecidas por la IUPAC nos basaremos para abordar los siguientes contenidos.
Fórmulas químicas de compuestos químicos
Cuando dos o más elementos se combinan en proporciones de masa definidas, forman un compuesto químico, el cual se representa con los símbolos de cada uno de los elementos integrando una fórmula química. En una fórmula química, los símbolos representan átomos, y los subíndices, el número de ellos. En caso de que no lleve algún subíndice, el símbolo representa la unidad o, en otras palabras, un átomo de ese elemento.
HNO3
Como recordarás, los elementos químicos se combinan gracias a los enlaces químicos así, para escribir una fórmula química es importante considerar los conceptos de valencia y número de oxidación.
Valencia es un número entero que se utiliza para describir la capacidad de combinación que tienen los átomos.
En algunos elementos, la valencia coincide con el grupo al que pertenece y puede ser positiva, cuando el átomo cede o pierde uno o más electrones al combinarse (en el caso de un metal) y pierde o comparte electrones (si es un no metal). También
puede ser negativa si el átomo gana o comparte uno o más electrones.

Pese a lo anterior, los elementos a partir del grupo IV A pueden tener más de una valencia, por lo que se introduce el concepto de número de oxidación. El número de oxidación es un número entero positivo o negativo, que se utiliza
para describir la capacidad de combinación con base en ciertas reglas, las cuales nos proporcionan un método de contabilidad electrónica.
El número de oxidación se determina por la posición donde se encuentra el elemento químico en la tabla periódica, que se relaciona con la electronegatividad y puede tener valor positivo o negativo, según el otro elemento con el que se combine
o enlace. Para conocer la forma de asignar los números de oxidación de los elementos, se consideran las siguientes reglas:
- El número de oxidación de un elemento libre es cero. Por ejemplo, Zn, H2, N2, C.
- El número de oxidación del oxígeno es -2, excepto en peróxidos que es -1, por ejemplo, en CO2, CdO.
- El número de oxidación del hidrógeno en la mayoría de los compuestos es +1, excepto en los hidruros metálicos e hidruros no metálicos de los grupos III, IV y V A. Por ejemplo: H2O (+1), NaH (-1)
- El número de oxidación de los metales alcalinos es +1, por ejemplo, Rb +1.
- El número de oxidación de los metales alcalinotérreos es +2, por ejemplo: Ba3P2.
- El número de oxidación de un ion es igual a su carga, por ejemplo, (OH)-1.
- La suma de los números de oxidación de los elementos que forman un compuesto es 0.
La siguiente tabla muestra los números de oxidación más comunes.

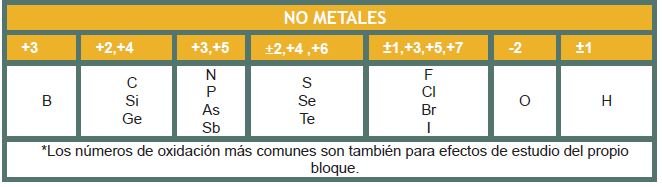
Procedimiento para asignar los números de oxidación de los elementos en un compuesto o ión poliatómico:
a) Se escriben, en la parte superior de los símbolos de los elementos, los números de oxidación que se conozcan.
b) Se multiplica el número de oxidación de cada elemento por el número de átomos del mismo, presentes en el compuesto.
c) Se indica, en la ecuación, que la suma de todos los números de oxidación es igual a cero y se resuelve la ecuación.
Ejemplo: Calcular los números de oxidación de los siguientes compuestos.



Compuestos químicos inorgánicos
Antes de iniciar, es necesario describir cuál es la manera de escribir las fórmulas y el modo en el que se deberán nombrar, de tal forma que tenemos lo siguiente:
Método para escribir fórmulas
La fórmula de un compuesto está formada por una parte positiva y otra negativa, de tal manera que se neutralizan, es decir, los compuestos son electrostáticamente neutros y dicha neutralidad está dada por los números de oxidación de los elementos que anteriormente se mencionaron.
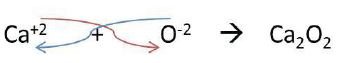
Para escribir las fórmulas, primero se coloca la parte positiva y luego la negativa; a continuación los números de oxidación se intercambian cruzándolos y colocándolos como subíndices ya sin signo.
Ejemplo:
Se observa que los subíndices tienen un común denominador, porque se simplifican a su mínima expresión y queda lo siguiente:
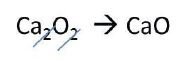
En algunos casos se tienen compuestos con grupos funcionales que agrupan elementos, presentan carga y actúan como unidad; por ejemplo: OH-1, SO4-2, CO3-2, etc. Al combinarse sucede lo mismo que en el caso anterior.
Ejemplo:

Funciones químicas inorgánicas
Para la nomenclatura de los compuestos químicos inorgánicos, hay que tener presente que existe una clasificación que permite identificar las propiedades comunes de las sustancias, como son el tipo de enlace, número de elementos que los forman o función química. Así tenemos la siguiente clasificación de compuestos por su función química.

Para nombrar los compuestos químicos inorgánicos tomaremos los siguientes tipos de nomenclatura:
a) Nomenclatura Stock.
Esta nomenclatura se utiliza para diferenciar a los elementos que tienen más de una valencia y se indica con números romanos entre paréntesis la valencia con la que actúa el catión en el compuesto. Si se tiene sólo una valencia, no es necesario
indicarla.
- Ejemplo:
- 1 valencia: Al2O3 Óxido de aluminio
- 2 Valencias:
- FeO Óxido de hierro (II)
- Fe2O3 Óxido de hierro (III)
b) Nomenclatura tradicional
Para esta nomenclatura es necesario usar ciertos prefijos y sufijos que indican la valencia con la que el elemento está actuando en ese compuesto; como viste anteriormente, hay elementos que actúan con 1, 2, 3 o 4 valencias distintas. A continuación se presenta la siguiente tabla para que te quede más claro.

Ejemplo:
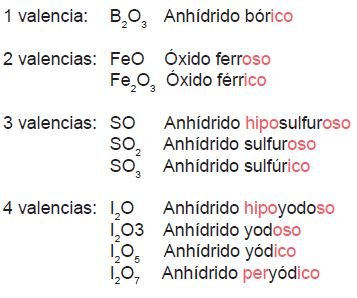
Importante: existen algunos elementos que por su raíz etimológica cambian en la nomenclatura tradicional, por ejemplo:

Óxidos metálicos
El oxígeno se combina con casi todos los elementos de la tabla periódica para formar compuestos variados que abundan en la corteza terrestre llamados óxidos, donde el oxígeno actúa con su número de oxidación -2 y los metales con los números de oxidación antes vistos.
Los óxidos metálicos resultan de la combinación de un metal con oxígeno:

Para nombrarlos se utiliza la palabra óxido seguido del metal con la terminación correspondientes (según la tabla de sufijos) en la nomenclatura tradicional y la palabra óxido seguida del metal y la valencia representada con un número romano (en caso de no ser la única).
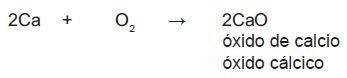
Ejemplo 1. Escribe el nombre de los siguientes compuestos:

Ejemplo 2. Escribe la fórmula de los siguientes compuestos:

Propiedades de los óxidos metálicos:
• La unión se realiza a partir de un enlace iónico.
• Casi siempre forman compuestos cristalinos.
• Al reaccionar con el agua forman hidróxidos o bases.
• Presentan un punto de ebullición muy alto.
• Tienen punto de fusión elevado.
• Muchos son insolubles en agua pero solubles en medio ácido.
• Producen corrosión de los metales al estar expuestos al oxígeno.
Óxidos no metálicos
Los óxidos no metálicos también se conocen como anhídridos, donde sabemos que el oxígeno actúa con su número de oxidación -2 y los no metales con los números de oxidación antes vistos.
Los anhídridos resultan de la combinación de un no metal con oxígeno:
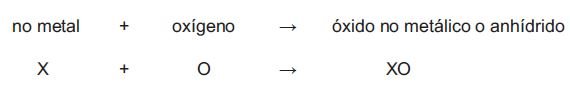
Para nombrarlos se utiliza la palabra anhídrido seguida del no metal con la terminación correspondiente (según tabla de sufijos y prefijos) en la nomenclatura tradicional y la palabra óxido seguida del no metal y la valencia representada con un
número romano (en caso de no ser la única).
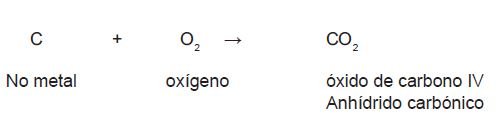
Ejemplo 1. Escribe el nombre de los siguientes compuestos:

Ejemplo 2. Escribe la fórmula de los siguientes compuestos

Propiedades de los anhídridos:
- La unión se hace a través de un enlace covalente.
- Están formados por elementos con alto valor de electronegatividad.
- Muchos son gaseosos.
- Al combinarse con el agua forman ácidos.
- Presentan puntos de fusión muy bajos.
- Tienen un punto de ebullición bajo.
Hidruros metálicos
Al combinarse con un elemento metálico, el hidrógeno forma compuestos llamados hidruros, los cuales se caracterizan por ser los únicos donde el hidrógeno actúa con su número de oxidación -1.

Para nombrarlos se utiliza la palabra hidruro seguida del metal con la terminación correspondiente (según tabla de sufijos) en la nomenclatura tradicional y la palabra hidruro seguida del metal y la valencia representada con un número romano (en caso de no ser la única).
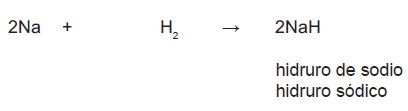
Para escribir la fórmula, se siguen los mismos pasos que en los óxidos; se escribe primero la parte positiva (mental) y después la parte negativa (hidrógeno), como se muestra en el siguiente ejemplo:
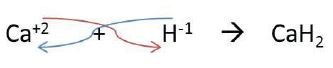
Hidrácidos
En disoluciones acuosas, los haluros de hidrógeno o hidrácidos dan disoluciones ácidas. Los hidrácidos resultan de la combinación de los no metales de los grupos VI y VII y el hidrógeno.

El hidrógeno actúa con su número de oxidación positivo y los no metales con el negativo.
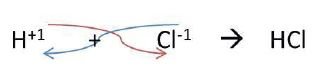
Para nombrarlos, se escribe primero la palabra ácido seguida del nombre del no metal con el sufijo «hídrico» en la nomenclatura tradicional; y en la nomenclatura Stock, se usa el sufijo «uro» seguido de «de hidrógeno«, como se muestra a continuación en el ejemplo:

Propiedades de los hidrácidos
- A temperatura ambiente son sustancias gaseosas.
- Son solubles en agua.
- En disolución conducen la corriente eléctrica.
Con el resto de los no metales se forman los hidruros volátiles; estos compuestos están unidos por enlaces covalentes poco polares y se diferencian de los hidrácidos por no tener propiedades ácidas. Los elementos que forman estos compuestos son
N, P, As, Sb, C, Si y B.
Para nombrarlos se utilizan nombres especiales (nombre común) admitidos por la IUPAQ, además de la nomenclatura tradicional semejante a los hidruros metálicos.

Hidróxidos
Los óxidos metálicos reaccionan con el agua produciendo hidróxidos, que son compuestos con propiedades muy variadas y con muchas aplicaciones en la industria y en la vida cotidiana. Los hidróxidos están constituidos por un catión y el grupo
(OH)-1.

Para nombrarlos se utiliza la palabra hidróxido seguida del metal con la terminación correspondiente (según tabla de sufijos) en la nomenclatura tradicional, y la palabra hidróxido seguida del metal y la valencia representada con un número romano (en caso de no ser la única).

Los metales, como siempre, actúan con sus números de oxidación positivos y el grupo hidróxido con -1. Para escribir la fórmula de un hidróxido se escribe primero el metal y a continuación el grupo hidróxido, se intercambian sus números de oxidación y se escriben los índices. En el caso de que el metal tenga número de oxidación diferente a +1, el grupo hidróxido se escribe entre paréntesis.
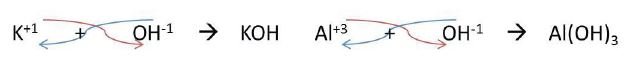
Propiedades de los hidróxidos o bases:
- Tienen un sabor amargo.
- Son jabonosos al tacto.
- Se neutralizan para formar sales.
- Sus soluciones acuosas son electrolíticas.
Oxiácidos
Los óxidos no metálicos o anhídridos reaccionan con el agua produciendo ácidos. Los oxiácidos son compuestos que están constituidos por hidrógeno, un no metal y oxígeno.

Para nombrarlos, primero se indica el nombre genérico ácido, después el nombre del no metal que contiene, con los prefijos y sufijos que se mostraron anteriormente de acuerdo al número de valencias del elemento.
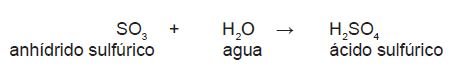
Para obtener la fórmula de un oxiácido, es necesario saber que el nombre del ácido lo determina el anhídrido del que proviene, por ejemplo:
El ácido sulfúrico proviene de anhídrido sulfúrico:
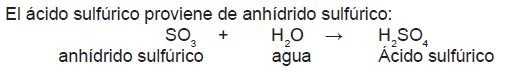
Ejemplo:
El ácido nitroso proviene del anhídrido nitroso (reducido a su mínima expresión):

Existe una excepción para los anhídridos del boro, fósforo y arsénico: al formar sus ácidos respectivos es necesario combinarlos con tres moléculas de agua, como se muestra en el siguiente ejemplo:

Recuerda que es necesario reducirlo a su expresión mínima.
Propiedades de los oxiácidos:
- Reaccionan con las bases para formar sales y agua.
- Presentan un sabor agrio y poseen un pH con rango que va de siete a cero.
- Disueltos en agua son electrolitos.
- Al disolverse en agua forman iones.
Sales
Las sales son compuestos que resultan de sustituir los hidrógenos de los ácidos por un metal, que se forma por la unión del anión del ácido H+ y el catión de la base OH-1. A este proceso se le denomina reacción de neutralización. Las sales a su vez
se clasifican en dos:
Sales binarias
También llamadas haloideas se producen por la combinación entre un metal y un no metal. Son el resultado de hacer reaccionar un hidrácido con un hidróxido o base:
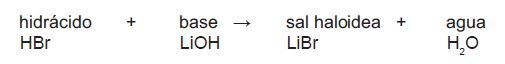
Para determinar su nomenclatura, se nombra primero el no metal con la terminación «uro», seguido del metal correspondiente con el sufijo correspondiente en la nomenclatura tradicional, o bien, la valencia representada con un número romano (en caso de no ser la única) para la nomenclatura Stock.

Ejemplo:

Oxisales
Una oxisal está formada por un metal, un no metal y oxígeno. Son el resultado de hacer reaccionar un oxiácido con un hidróxido o base:

Para la notación de la oxisal se escribe primero el metal seguido del anión de acuerdo con la tabla de aniones más comunes que se encuentra posteriormente. En la nomenclatura se nombra primero el anión seguido del metal. Los aniones resultan de la eliminación de uno o de todos los hidrógenos de los ácidos, siendo su valencia el número de hidrógenos eliminados. Si la terminación del ácido es «oso» cambiará a «ito», y si termina en «ico» cambiará a «ato».

Tabla de los principales aniones
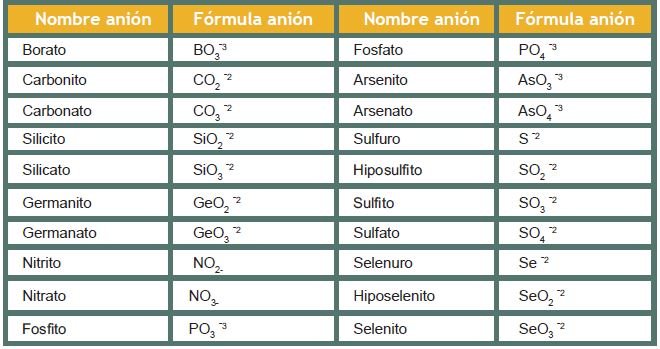

No olvidemos que, si el metal tiene más de una valencia, se indica al final del nombre con números romanos en el caso de la nomenclatura Stock, y usando los sufijos en la nomenclatura tradicional.
Ejemplo:

Propiedades de las sales:
- Son sustancias de estabilidad relativa.
- Su actividad y solubilidad están condicionadas por los elementos que la integran.
- En disolución acuosa conducen la corriente eléctrica.
- A temperatura y presión ambientales son sólidos cristalinos.
- Su punto de fusión y ebullición son relativamente altos.
- Muchas se disuelven con gran facilidad a temperatura ambiente.
- En estado sólido no conducen la corriente eléctrica, pues son aislantes.
Fuente: Secretaría de Educación Pública. (2015). Química I. Ciudad de México.
Categorías:Preparatoria, Química de preparatoria